Aufbau von Gelée Royale gelüftet
Gelée Royale besitzt eine einzigartige dreidimensionale Struktur. Grafik: Mattei, S., Ban, A., Picenoni, A. et al. 2020/CC BY 4.0
Gelée Royale besitzt eine einzigartige dreidimensionale Struktur seiner Proteinfilamente, die für die extreme Viskosität sorgen. Hochauflösende Mikroskopie hat nun das Geheimnis des Aufbaus von Gelée Royale lüften können.
Das Sekret Gelée Royale wird von Arbeiterinnen der Honigbienen Apis mellifera als Nahrung für Larven produziert. Sie erhalten es während der ersten drei Tage ihrer Entwicklung, Königinnen dagegen fortwährend als einzige Nahrung.
Die Zellen von Königinnen werden bei den Honigbienen jedoch nicht horizontal, sondern vertikal ausgerichtet. Das Gelée Royale in den Königinnenzellen befindet sich quasi an der Decke der Zelle und muss daher eine starke Bindung aufweisen.
Diese außergewöhnliche Viskosität ist auf die hohe Konzentration langer (> 1 Mikrometer) supramolekularer Glycolipid-Proteinfilamente im Gelée Royale zurückzuführen.
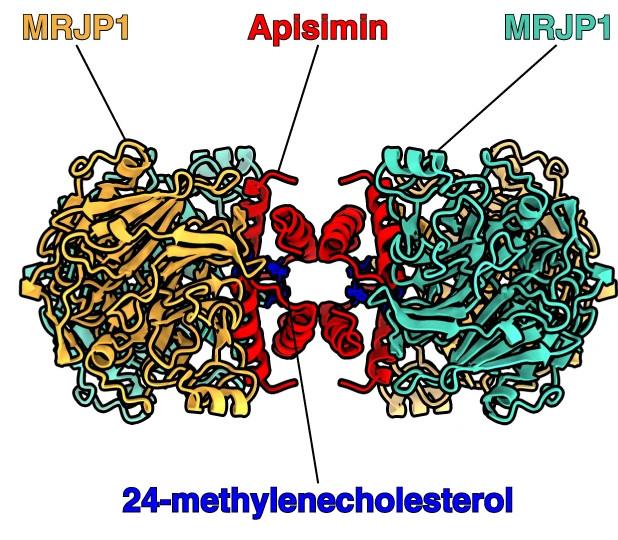
Wissenschaftlern gelang es nun, die dreidimensionale Struktur dieser bemerkenswerten Filamente auflösen. Die Bausteine der Filamente erwiesen sich als heterooktamere, H-förmige Proteinkomplexe, die aus vier Kopien des Proteins MRJP1 auf der Außenseite und vier Kopien des kleinen hydrophoben Peptids Apisimin im Zentrum bestehen; mit ihnen interagieren acht Moleküle 24-Methylen-Cholesterin und Lipide. In den Filamenten des Gelée Royales sind die heterooktameren Komplexe so gestapelt, dass jedes Heterooktamere gegenüber dem vorherigen um 64 Grad versetzt ist.
Für die Ordnung der Filamente sorgt der saure pH-Wert 4. Dies führt zur Protonierung von Glutamatresten von MRJP1 an den Grenzflächen zwischen benachbarten Heterooktameren, die eine gegenseitige elektrostatische Abstoßung der Heterooktamere verhindert.
Der pH-Wert im Darm der Larven ist mit einem ph-Wert von 7 neutral. Die Glutamatreste werden negativ geladen, sodass Gelée Royale letztlich seine Viskosität im Darm verliert und für die Verdauung zugänglich wird.
Mattei, S., Ban, A., Picenoni, A. et al. Structure of native glycolipoprotein filaments in honeybee royal jelly. Nat Commun 11, 6267 (2020). https://doi.org/10.1038/s41467-020-20135-x
